
奶牛乳房炎是奶牛饲养中的常见疾病,该病病因复杂,且发病率较高,对奶牛产业产生巨大的影响[1]。该病主要是由微生物引起的,或因理化刺激导致的乳腺炎症,其中大肠杆菌、链球菌及葡萄球菌等都是造成该病的病原菌[2],本研究主要探究抗菌肽NZ2114 对奶牛乳房炎源金黄色葡萄球菌细胞膜、基因组和耐药性的影响,以期为临床治疗药物研制开发工作提供有效的数据、理论参考。
主要试剂:纯化抗菌肽NZ2114(由锦州医科大学生命科学院纯化保存),培养基、细菌基因提取的试剂盒、聚合酶、碘化丙啶等购自大连宝生物试剂有限公司。
相关仪器:全温振荡培养箱(银川市金属制品厂)、冷冻离心机(Sigma)、酶标分析仪(Thermo Fisher)、超净工作台(海尔)、流式细胞仪(Thermo Fisher)等。
1.2.1 病菌的分离鉴定
从患病奶牛体内提取样本,首先用75%的酒精对奶牛乳头实施消毒处理,待牛乳头自然风干后取奶样,弃去前3 把奶,从第4 次奶样本开始采集,每次吸取20mL 样品置于无菌管内,4℃储存备用,在18h 内进行后续试验。把样品接种到培养基内,37℃下培养12~18h,挑取单菌落进行革兰氏染色,全面观察相应菌落的形态变化,提取细菌基因组,进行基因鉴定。随后将确定后的葡萄球菌放置在30%的甘油MH 液体培养基内-20℃储存。
1.2.2 杀菌活性检测
在抗菌肽NZ2114 作用下,对葡萄球菌活性进行最小抑菌浓 度值(Minimum Inhibitory Concentration,MIC)测定。将菌体接种到平板培养基内,250r/min 振荡,37℃环境下培养过夜,跳取单菌落,将其转移到MH 液体培养基中,活化至对数生长期。将得到的病菌充分震荡制作为菌悬液,在96孔培养板中进行无菌培养。用磷酸缓冲盐溶液(Phosphate Buffered Saline,PBS)将抗菌肽NZ2114 进行两倍稀释,以每孔10μL 的标准接种至96 孔细胞培养板中,并设PBS 阴性对照组,MH 培养基为空白对照组。实施3 个平行样板的处理,把培养板放到37℃孵化培育16~18h,直到阴性对照孔中产生较为明显的浑浊细菌液体,可对细菌成长形成有效抑制作用的浓度便是抗菌肽NZ2114 MIC 值。
1.2.3 细胞膜完整性试验
采用流式细胞术分析测定细胞膜的完整性。将过夜培养处在对数生长期的葡萄球菌液进行细胞处理计数后,用含2%牛血清白蛋白的PBS 重悬细胞,使细胞浓度为1×107/mL,吸取100uL 制备待测样品,终浓度为1×106/mL。待测样品中加入抗菌肽NZ2114,得到4×MIC、2×MIC、1×MIC、1/4×MIC 的待测样品,并设置空白对照和阴性对照,充分混匀37℃培养0.5h 后离心,弃去上清液,用PBS 冲洗两遍。再用上机检测前加入碘化丙啶(Propidium Iodide,PI)染液,直至液体浓度为50μg/mL,再放置室温下孵化15min,然后利用流式细胞仪全面记录PI 着染的阳性细菌细胞数量[3]。
1.2.4 耐药性检测
扫描电镜观察中,把葡萄球菌培养到对数生长期限为止,通过PBS 进行稀释,形成菌悬液。随后将抗菌肽NZ2114 添加到菌悬液内,对其浓度进行合理调整。将没有添加抗菌肽NZ2114 的PBS 当成阴性对照组,37℃静置培养2h,4000r/min 离心5min,使用PBS 对细菌进行两次清洗。在菌体沉淀中加入戊二醛缓冲液,进行轻吹混匀,悬浮完成后,于4℃冰箱固定过夜。之后进行漂洗并用乙醇梯度脱水,每次15min。然后样本用临界点干燥仪进行干燥处理。并在样品外表镀上一层金属膜,再用电子显微镜进行扫描。在葡萄球菌实施耐药基因检测中,需要把病菌体放置于对数生长期内,随后将其制成菌液模式,将抗菌肽NZ2114 添加到菌液中,调配到合理浓度,提取抗菌肽NZ2114 处理前后细菌基因样本,并针对多黏菌素、杆菌肽类及内酰胺类等药物实施耐药基因检测。
抗菌肽NZ2114 的抑菌活性分析相关测定结果如下(图1),抗菌肽NZ2114 在葡萄球菌中的从S1 到S10MIC 主要是0.5、1、1、1、0.5、1、0.5、1μg/mL。将拥有广泛耐药谱的S7 葡萄球菌当成代表菌种开展完整细菌胞膜分析。研究结果表明,未被抗菌肽NZ2114 有效处理过的病菌体,基本上未观察到PI 感染情况,可以证实病原菌保留了完整的细胞膜。被处理过的病菌体,有5%的PI 穿膜率,因此得出葡萄球菌细胞膜可被抗菌肽NZ2114 损坏,但没有太大的依赖性[4]。
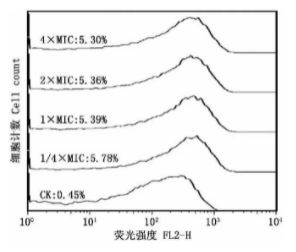
图1 流式细胞仪葡萄球菌细胞分析结果
抗菌肽NZ2114 对葡萄球菌拥有较强的抑菌活性。碘化丙啶属于核酸染料,会与细胞中的RNA 及DNA 产生特异性结合,在细胞膜有完整结构的条件下,碘化丙啶无法进入细胞内,但在细胞膜遭受破坏后可以顺利进入,并与细胞中的核酸进行有机融合,通过流式细胞仪能检测到一种红色荧光,计算染色细菌比例。碘化丙啶在细胞中的数量越大,所产生的荧光强度越强,为此可以根据荧光的强弱程度对细胞膜破坏程度进行判断。
由图2 可知,仔细观察电镜下抗菌肽NZ2114 处理过程。未经抗菌肽NZ2114 作用的细胞表层形态未发生改变,电镜下显示为饱满的病菌细胞,并且各细胞比较分散,且细胞表面光滑。被抗菌肽NZ2114 处理的病菌细胞的胞内物质会露出且细胞体积缩小。随着不断加入抗菌肽,病菌细胞受损程度随着抗菌肽NZ2114 浓度的增高而加大。
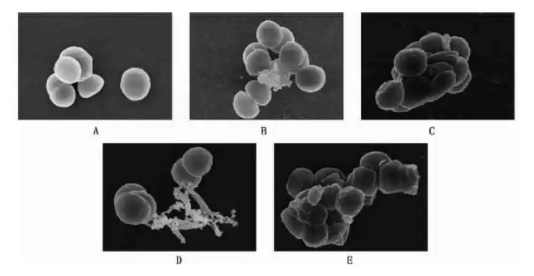
图2 抗菌肽NZ2114 对葡萄球菌形态影响
抗菌肽NZ2114 对葡萄球菌处理前后耐药率结果如表1所示。在葡萄球菌药敏试验中,经过抗菌肽NZ2114 处理后相关病菌体对某种抗生素敏感性有所提高。进一步检测其耐药基因可以发现,抗菌肽NZ2114会对葡萄球菌内部基因组携带耐药基因产生影响。某些耐药基因在处理后无法检测,拥有稳定的遗传特性。
表1 抗菌肽NZ2114 对葡萄球菌处理前后的耐药率 单位:%
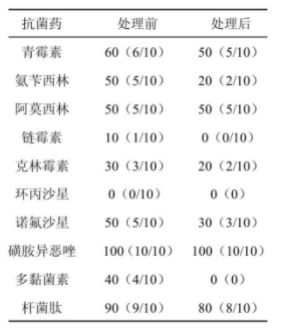
注:N(X/Y),N 为耐药率,X 为耐药株数量,Y 为受试菌株数
通过分析能够发现在应用抗菌肽NZ2114 前,90%~100%未经处理的葡萄球菌对磺胺异恶唑与杆菌肽有耐药性、50%~60%对含有内酰胺的抗生素有耐药性、40%对粘菌素耐药性、50%对诺氟沙星有耐药性、30%对克林霉素有耐药性、10%对链霉素有耐药性。另外一部分葡萄球菌存在多重耐药,同时对青霉素、磺胺异恶唑及杆菌肽等耐药。但目前还没有找到对环丙沙星耐药的菌株。葡萄球菌被抗菌肽 NZ2114 处理后,其对内酰胺抗生青霉素、氨苄西林等耐药率降低了30%、10%,对多黏菌素B 的耐药率下降几乎达到了40%,对阿莫西林、磺胺异恶唑等药物的耐药率没有明显改变,对其余抗生素的耐药率都显著下降。
试验结果表明葡萄球菌细胞膜可被抗菌肽NZ2114 损坏,在电镜下细胞膜随着抗菌肽作用时间越长损伤越大,同时经抗菌肽NZ2114 作用后耐药性明显降低。证明抗菌肽NZ2114针对金黄色葡萄球菌有一定的抑制杀菌效果。
下一篇: 肝片吸虫病的病原症状诊断与防治方法
上一篇: 布病综合防控技术措施分析
京ICP备13017971号地址:北京市朝阳区农展北路55号
北京华牧直通广告有限公司 版权所有 电话:010-59195279Email:zgzysyw@126,com