杂质作为药品的一项关键质量属性,其研究是一项重要系统工程。杂质谱分析对指引药品制备工艺的研发和优化具有指导意义,只有在全面杂质谱分析基础上,药品质量控制才能有的放矢;杂质谱分析也是杂质检查工作和建立合理可行检查方法的前提。本文对化学合成原料药的杂质分析的一般原则、研究思路和实际工作情况进行梳理。CTD 格式申报资料要求药品研发企业对杂质分析必须具备以下分析研究:(1)列出产品中可能的杂质列表,分析杂质的来源;(2)对已知杂质给出化学结构并提供结构确证研究资料;(3)杂质情况分析:杂质名称、杂质结构、杂质来源、杂质控制限度、是否定入质量标准。有机杂质分析是研究产品中实际存在的杂质和潜在杂质。有机杂质潜在来源为工艺杂质及降解产物。工艺杂质包括起始原料、中间体、试剂、配位体、催化剂等。原料引入的杂质(根据其合成工艺分析杂质情况,重点关注可引入后续反应的潜在杂质);副产物(结合工艺分析可能的副产物,清楚或了解及后续工艺中的去向,后续反应情况,重点关注可引入后续反应的副产物);合成过程中产生的降解产物(通过对药物中的活性基团和不稳定基团进行分析推测,药物的降解途径和降解产物)。对原料药合成过程和储存过程中最可能产生的实际存在和潜在的杂质进行综述分析,评估原料引入的杂质情况,深入理解制备工艺,掌握杂质的由来、去向,科学分析工艺杂质。研究方法包括结构特征分析、稳定性试验、强制降解试验。强制降解试验的目的如下:(1)了解待测药品对氧化、光照、酸、碱、湿、热等的敏感程度,潜在的降解途径和降解产物情况;(2)验证分析方法是否可行,是否为专属性的检查方法;(3)为药品的长期试验和加速试验放置条件提供依据;(4)为选择包装材料提供依据。固体原料药样品应取适量放在适宜的开口容器中,分散放置,厚度≤3 mm;必要时加透明盖子保护(如挥发、升华等)。液体原料药应放在化学惰性的透明容器中。根据研究目的适度降解,主成分降解指标约为10%,较稳定的药物,不必继续采用过于强烈的试验条件。高温试验条件一般高于加速试验温度10 ℃以上(如60 ℃等),高湿试验条件通常采用75%RH或92.5% RH,光照试验的总照度≥1.2×106 Lux·hr、近紫外能量≥200 W·h / m2。另外还有酸破坏和碱破坏试验。考察时间点应基于原料药本身的稳定性及强制试验条件下稳定性的变化趋势设置;时间通常可设定为0、5、10、30 d 等。无机杂质包括催化剂、配位体和试剂;金属杂质(主要产生途径为在药物生产过程中接触到的容器引入或者使用试剂和催化剂等时引入);无机盐;其他物质(例如过滤助剂、活性炭等)。质量控制:通常按药典方法或其他合适的方法来检测及定量。全面分析原料药中残留溶剂的可能引入途径如下:(1)合成原料或反应溶剂;(2)作为反应副产物引入,如甲酯水解生产甲醇;(3)其他合成原料或其他溶剂带入,如甲苯、苯胺中的少量苯;(4)其他物质(如大孔吸附树脂中残留的苯、甲苯等)。残留溶剂分析需列表说明工艺中有机溶剂的使用情况:溶剂名称、来源、溶剂类别、控制限度、是否定入质量标准。残留溶剂一般用气相色谱法检测。手性杂质在一般药品研发中很少碰到,而在手性药物中多见。手性杂质的研究是杂质研究中的一个难点,鉴于其复杂性和特殊性,可参见《手性药物质量控制研究技术指导原则》。手性杂质具体常用的分析方法为设立比旋度、色谱方法、直接拆分(手性柱、手性添加流动相)、间接拆分(衍生化)。根据合成工艺,对产品中可能存在的杂质进行研究。如果可以直接购买到杂质对照,可以购买得到,进行质谱及氢谱分析,确定化学结构。但是实际工作中,由于所研发药品比较新颖和前沿,市场上没有杂质对照品提供,无法购买得到,所以就需要研发单位自己合成、纯化得到杂质对照品,进行质谱及氢谱分析,确定化学结构。
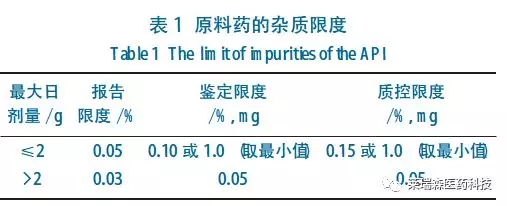
有关物质杂质的分析主要是对样品中各杂质含量、数量,以及各杂质的来源,有关物质的杂质研究要在整个质量研究过程中,对于杂质含量超过0.1%的未知杂质要确定其结构、毒性等基本信息;对已知杂质与新增加的杂质均要分别控制,确定杂质的变化情况。有关物质杂质限度的制订,首先应从安全性方面进行考虑,尤其对于有毒理活性或药理活性的杂质,设定的杂质限度不能高于安全性试验结果所能支持的水平;其次在保证药品安全的基础上,杂质限度的确定主要基于中试规模以上产品的实际检测数据,应考虑生产规模下杂质水平是否可以控制在此水平及批次之间的正常浮动;考虑药品本身的稳定性及生产情况的误差,往往对限度做适当放宽。同时对于仿制药还应考虑原研药品的杂质的限度,自制药品应与原研药品的杂质在同一水平,如不能在同一水平,仿制药明显杂质含量高于原研药品杂质含量,则应做必要的安全性研究,获得安全性数据支持。杂质水平在一定程度上反映了药品的质量,在政府和消费者越来越注重药品品质的大环境下,杂质研究就显得尤为重要。杂质研究是药品研发过程中一项非常重要的内容。国务院和国家食品药品监督管理总局对药品质量非常重视,政策新规层出不穷,企业要紧跟国家药品政策法规,认真研读各项药品研发指导原则。企业亦应探究药品分析中的技术要点,并确立科学的杂质研究思路和步骤。