2019年10月29日,中国科学院微生物研究所高福院士团队在微生物研究领域权威期刊mBio在线发表了题为Crystal Structure of African Swine Fever Virus dUTPase Reveals a Potential Drug Target的文章,在非洲猪瘟病毒关键酶结构解析与药物靶点研究中取得突破性进展。
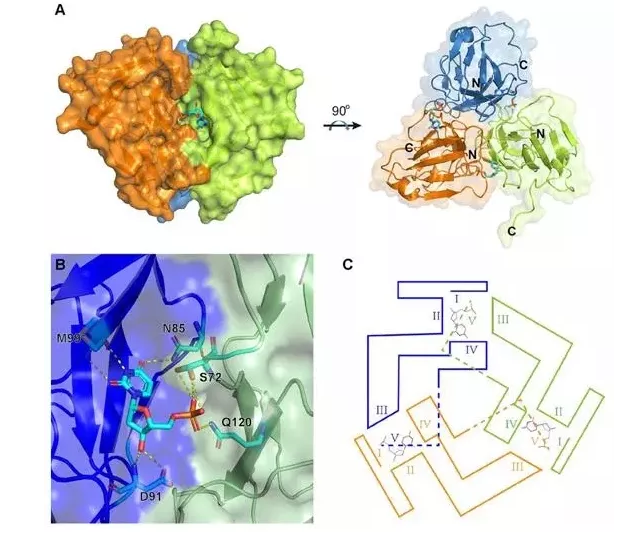
非洲猪瘟是一种由非洲猪瘟病毒(ASFV)引起的急性、热性、接触性动物疫病,所有品种和年龄的猪均可感染。1921年在非洲肯尼亚首次发现,如今已传播至欧洲、南美洲、亚洲。2018年8月,非洲猪瘟蔓延到中国,就像一场大火般烧开,成了一场大灾难。2019年以来,曾暴发或正在暴发疫情的国家和地区有26个,我国和越南受灾最严重。目前还没有有效的疫苗和药物来阻止病毒的传播。因此迫切需要研发有效的预防和治疗ASFV感染的药物或疫苗。非洲猪瘟病毒是一种正二十面体的巨大病毒,由基因组、核心壳层、双层内膜、衣壳和外膜组成,病毒颗粒包含3万余个蛋白亚基,组装成直径约280纳米的球形颗粒,这是目前解析近原子分辨率结构的最大病毒颗粒。dUTP焦磷酸酶(dUTPase)是DNA合成中的一种关键酶,广泛分布于真核、原核细胞以及病毒等生命有机体内。该酶能够水解细胞质中的dUTP,从而最大限度地减少尿嘧啶在DNA合成中的错误插入,降低细胞中dUTP/dTTP的比例,维持基因组复制的保真度和顺利进行。ASFV也编码这种酶,称为E165R。研究人员解析了apo-E165R和E165R-dUMP复合体的晶体结构,为靶向E165R的抗ASFV药物设计提供了重要依据。
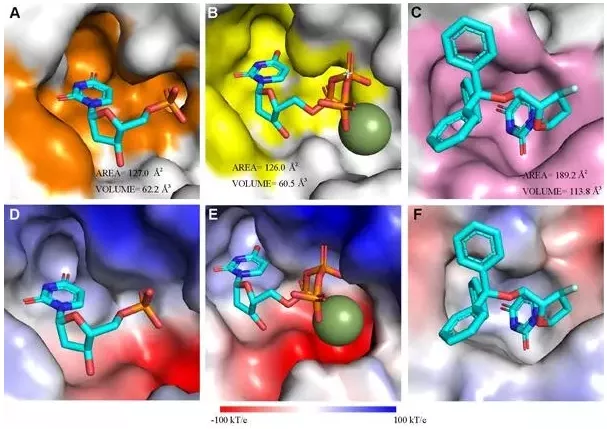
E165R-dUMP与其它物种dUTPases-产物/抑制剂的结构比较通过解析apo-E165R和E165R-dUMP复合体的晶体结构,分析确定了酶活性位点的结构,以及与配体dUMP之间的相互作用位点(图1)。进一步通过比对ASFV-E165R与其它物种的dUTPase的结构,发现E165R的活性位点与结核分枝杆菌和恶性疟原虫的dUTPase的活性位点高度相似(图2)。而结核分枝杆菌和恶性疟原虫的dUTPase已被证明能够作为药物设计的靶点,如α,β-imido-dUTP(dUPNPP)已被用来抑制结核分枝杆菌的dUTPase活性;一些脱氧尿苷三苯基甲烷衍生物也被发现具有抗疟活性。因此针对ASFV-E165R活性位点开发的小分子化学药物很可能对ASFV有效。研究结果为靶向E165R的抗ASFV药物设计提供了重要依据。中国农业大学博士生李长尧为论文的第一作者,高福院士和中国科学院微生物研究所孙业平为论文共同通讯作者。此外,中国科学院微生物研究所齐建勋研究员、施一研究员和柴彦博士以及中国农业科学院哈尔滨兽医研究所翁长江研究员、中国科学院北京生命科学研究院宋豪博士等专家也提供了大力支持。本研究得到了中国科学院非洲猪瘟研究应急项目、国家自然科学基金、科技部重点研发计划,以及中科院青促会、中国科协“青年人才托举工程”等的经费支持。