
图 1. 细胞质中ASFV颗粒的形态
一、ASFv传播方式
非洲猪瘟病毒在中国的传播方式目前主要为两种,一种是在家猪之间的传播,一种是各种形式的人类活动带来的传播。
1.1 ASFv可通过直接接触感染猪或经口鼻途径或皮肤擦伤在感染猪群中水平传播。被感染猪的病毒含量非常高,特别是血液中的病毒量,这为猪的直接或间接传播提供了大量毒源。病毒也存在于其它排泄物和分泌物中,包括尿液、鼻腔分泌物和唾液。气溶胶传播被认为仅在短距离内发生(Olesen等,2017年)。在受污染物的表面、饲料或水中摄入病毒均可导致猪感染。
1.2、人类活动可导致短距离和长距离间ASFv的传播。这种病毒在肉制品中能存活数周或数月,喂给家猪后可能导致感染。加热肉制品会导致病毒失活,因此,熟肉没有造成感染的风险。其它类型的肉类加工,如干燥,不会立即灭活病毒,这类加工的肉类在不同时期内仍保持传染性。受病毒污染的其它材料,包括衣物、鞋子、运输工具和刀具等,也可成为间接传染源(Guinat等,2016年;Sanchez Vizzaino等,2015年)。ASF的长距离间传播通常涉及猪或野猪吃过受污染的猪肉。最近怀疑在中国和比利时发生了这类情况。感染猪长距离运输也会导致病毒传播。病毒在被感染猪的尸体或排泄物、分泌物中的稳定性也使这类成为了一个病毒贮存库,可间接传播给家猪,特别是在较寒冷的月份。病毒在极冷的温度下可以持续存活数周,甚至数月。ASF的早期临床症状不明显,极易与其它疾病混淆,因此,早期诊断困难,特别是一旦入侵到一个未曾怀疑过有ASF的地区。这时,在还未采取任何控制措施之前,ASFV可能就已传播开了。
二、非瘟猪瘟在亚洲的传播现状
2018年8月3日,中国辽宁省沈阳市首次爆发ASF疫情。然而,调查资料证实,这可能不是最初的疫情,因为在首次爆发ASF疫情两个月前,在沈阳市郊区发现了类似的症状(Wei等,2018)。例如,从邻近吉林省的一个村庄非法购买的一些仔猪开始出现ASF疑似症状,100头仔猪中有28头在3月24日死亡。7月6日,该农民把剩下的45头猪卖给附近的一个农场,但所有的剩余猪都很快死亡。观察到的主要临床和病理体征与急性ASF一致(Wei S.,2018)。电子显微镜下观察到两例死猪脾脏样本中存在ASFV类似病毒颗粒。PCR分析显示,脾脏、肝脏和肾脏中ASFV核酸均呈阳性。基因序列分析表明,B646L(p72)、E183L(p54)和B602L的序列与格鲁吉亚2007/1及其相关毒株(Chen等,2018;Zhou等,2018)的序列相同。中国动物卫生与流行病学中心(Ge等,2018年)确认两头死猪的组织样本ASFV呈阳性;中国农业和农村部立即启动了应急响应。虽然这些措施得到了妥善实施,但疫情传播非常迅速,中国大陆8月发生4起疫情,9月发生20起疫情,10月发生27起疫情,11月发生22起疫情。截至12月31日,来自23个省的家猪爆发了100多起疫情(图2)。中国政府估计,8月至11月期间的主要传播路线包括生猪和猪肉制品的跨区域运输(19%)、泔水(34%)和人车移动(46%)(Promed mail档案号:20181130.6173813)。野猪,包括野生和养殖的野猪在中国分布广泛。据报道,野猪爆发了两起ASF疫情。2018年11月16日,在靠近朝鲜边境的吉林省惠江区发现一头死亡野猪,经聚合酶链反应(PCR)分析,组织标本中ASFV呈阳性。综合流行病学调查结果,该病例与中国境内感染猪无直接关系,感染源不明。
2019年1月,蒙古国报告了ASF,并在7个不同省份进行了确认。粮农组织认为有可能已经传播到亚洲其他国家。这一点也得到了进一步的证实,因为已经有几例ASFV阳性猪肉产品被航空乘客运往其他亚洲国家(Promed邮件档案号:20190126.6279425)。2019年2月,越南当局报告了3起疫情,截至3月底,越南6个不同省份分别报告了33起疫情。考虑到中国和越南之间的贸易和运输,这一结果并不令人惊讶,这表明该地区存在ASFV进一步扩散的风险。
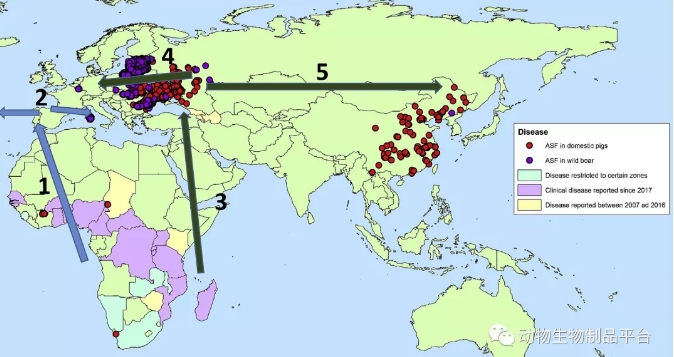
图 2. 2018年ASFV横贯大陆传播和家猪暴发及野猪检测的年表
三、非洲猪瘟控制策略
如上所述,在2018年8月3日报告的第一次非洲猪瘟爆发后,中国农业和农村部立即启动了应急响应(OIE档案号:20180803.5945484)。控制策略包括分区、在受影响区域内扑杀所有猪,安全处置死亡动物、产品和受污染物料、限制猪的运输和严格监测疾病。同时也采取了传统的卫生措施,包括限制泔水(含厨房废弃食品)喂养,通过临床症状和实验室诊断进行病毒的早期检测,彻底的清洗和消毒,全面进行流行病学调查以及对养猪场实施严格的生物安全措施。最后,实施适当的进口政策,确保不引入被感染的猪,也不引入被污染的猪肉产品。妥善处理来自受影响国家的飞机、船只或车辆上的废弃食品,以及管制非法进口生猪,及猪肉制品。总的来说,这些措施对减少疾病的传播是有效的。68次暴发的流行病学研究结果揭示了ASF病毒传播的3个主要原因:其中,46%由车辆和工人运输造成,34%由泔水喂养,19%由活猪及其产品跨地区运输造成。联合国粮农组织定期报告总结了所采取的其他措施(http://www.fao.org/ag/againfo/programs/en/empres/asf/situation_update.html)。然而,由于多方面复杂的因素,新的疫情仍在继续,包括难以控制的漫长边界,与受影响国家频繁的人员和产品交流,猪肉产品走私猖獗,国内家猪和野猪的数量大、密度高,庭院和小养猪场的生物安全措施差。由于早期临床症状易与其它疾病的混淆,控制生猪和猪肉制品的跨地区运输、以及早期检测ASF的困难,有可能导致该病延迟爆发。
四、非洲猪瘟疫苗的研发前景
上个世纪50年代第一次研究报告称,从ASF中恢复的猪可以抵御与之相等毒力病毒第二次攻击(Detray, 1957)。由于在这些研究中获得了高水平的免疫保护,疫苗开发的前景起初被认为是良好的。然而,迄今为止进展缓慢,商品化疫苗在该领域使用还需要数年时间。有证据表明,抗体在免疫保护中起到了作用,因为从已有抗体动物身上过继的抗体也可以部分保护猪免受攻击(Onisk et al., 1994; Wardley et al., 1985)。CD8+细胞免疫也被证明是必要的(Oura et al., 2005)。最近,一个专家组对研制有效的ASF疫苗及前景进行了总结,并发表了一篇综述性文章(Arias et al., 2017a)。
4.1 灭活病毒疫苗
ASFV的复杂性是疫苗研制延迟的一个主要因素。能诱导抗体阻止病毒感染细胞的灭活苗迄今尚未成功(Blome et al., 2014; Stone and Hess, 1967)。可能是因为病毒颗粒有两种感染形式,即细胞外和细胞内成熟,而中和抗体不能完全抑制这些不同病毒的感染。另外,ASFv有两种进入巨噬细胞的机制已被证实,即网格蛋白介导的内吞作用和大胞饮作用 (Andres, 2017; Hernaez et al., 2016)。 病毒颗粒的多层性即复合层含有80多种蛋白(Alejo et al., 2018),不同的蛋白存在于外膜以及胞内感染病毒粒子的表面,因此,中和抗体必须能针对这些不同的蛋白。研究发现,病毒蛋白p72/B646L, p54/E183L 和 p30/CP204L是已知的中和抗体靶点(Gomez-Puertas et al., 1996; 1998)。
4.2 减毒活疫苗
减毒活疫苗可诱导高达100%的免疫保护(King et al., 2011; Leitao et al., 2001; O'Donnell et al., 2017; Reis et al., 2016,2017),但是其安全性是个问题。包括疫苗株引起的不良反应,以及疫苗株的持续存在时间和传播力一直妨碍着此类疫苗的开发。候选的减毒活疫苗是通过细胞培养传代或通过从强毒株中合理地删除一些基因而产生的。此外,一些低毒力的分离株已被证明有作为疫苗候选株的潜力(Boinas et al., 2004; Leitao et al., 2001)。基因功能的研究进展已可确定要删除的靶基因、产生减毒活疫苗候选株。如抑制I型干扰素基因,MGFs 360和505/530 或 DP148RASFV等成员(O'Donnell et al., 2015; Reis et al., 2016; Reis et al., 2017);删除直接促病毒复制的相关基因,如B119L/9 GL(一种参与病毒装配所需氧化还原途径的蛋白)也已成功(Lewis et al., 2000)。缺失编码一些功能未知的蛋白基因,如DP96R/UK,,也导致了毒力衰减(O'Donnell et al., 2017). 从ASFV减毒株的研究中能吸取的经验包括,从不同毒株中删除基因并不总是有相同的效果。例如,从BA71株中删除编码CD2V蛋白的EP402R(导致红细胞与被感染细胞和病毒颗粒结合),导致病毒毒力减弱和诱导保护作用。但从不同的毒力株中删除此基因时,没有全部都观察到毒力减弱(Borca et al., 1998; Monteagudo et al., 2017)。一个减毒的ASF活疫苗的另一个要求是、要研究应用与减毒疫苗相对应的诊断试剂,以区分被自然感染和预防接种动物。这就要求通过从疫苗株中删除或修饰具有免疫原性的蛋白基因,作为标记用于血清学诊断。总之,活疫苗或减毒疫苗提供了最快捷的路径,但获得商品许可证并使用此类疫苗仍需要数年时间。
4.3 亚单位疫苗
基于单个或多个基因或蛋白的接种的ASF亚单位疫苗可能比减毒活疫苗更安全。重组蛋白p72/B646L、p54/E183L 和 p30/CP204L的组合,在一项研究中诱导了部分保护;但在另一项研究中却没有,尽管诱导了中和抗体 (GomezPuertas et al., 1996; Neilan et al., 2004)。CD2V/EP402R重组蛋白的接种也诱导了部分保护 (RuizGonzalvo et al., 1996)。接种CD2V/EP402R胞外结构域、p30/CP204L和p54/E183L的融合基因,以及泛素基因以及与小ASFV DNA片段库相关的DNA疫苗也能诱导部分保护。为了寻找更具保护作用的抗原,也使用过非复制病毒载体(例如腺病毒和牛痘病毒)整合一些ASFV基因接种猪,诱导出了良好的抗体和T细胞免疫应答,并对不同基因的免疫原性进行了排序(Jancovich et al., 2018; Lokhandwala et al., 2017)。尽管这些结果是有希望的,但仍需要进一步的工作来确定一个抗原库和一种可商用疫苗的接种方法。
五、非洲猪瘟抗病毒药物的研究
5.1 抗病毒药
在目前ASF缺乏疫苗的情况下,可考虑采用替代控制策略。小分子抗病毒药物的使用可限制病毒的复制,从而阻止过另一种猪病—经典猪瘟(CSF)的传播,这一概念已经得到了证实(Vrancken et al., 2009)。对CSF病毒感染猪使用过的一种抗病毒药物可使血液中病毒滴度降低1000倍,使病毒血症期缩短74%,使感染猪向哨兵猪的传播降低了85%。流行病学原理表明,使用抗病毒药物和更传统的策略(如先发制人的扑杀和紧急疫苗接种)可以有效地控制CSF的爆发 (Backer et al., 2013; Vrancken et al., 2009)。 ASFv具有许多复制所需的特异性酶类,包括RNA和DNA聚合酶,这些酶应该是抗病毒药物开发的良好特异靶点。有几种化合物已被证明在细胞培养中抑制了ASFV的复制(Frouco et al., 2017; Galindo et al., 2011; Hakobyan et al., 2018),但到目前为止还没有在猪身上进行过试验。
5.2 其他控制策略
已提出的其它控制策略,包括培育基因工程抗ASF猪。前提是必须首先确定一个成功的策略来抑制病毒复制。抗ASF猪在某些情况下可能会成功地实施于规模化猪场。
六. 展望
目前控制ASF策略很大程度上依赖于检疫和屠宰政策以及快速检测,这通常是无效的,并可能导致大量的动物被扑杀。选择安全有效的疫苗以及一些附加措施有助于控制ASF流行,并从野生和家猪中根除病毒。虽然发现了一些有希望的疫苗候选株,但是,在让这些疫苗候选株可商品化应用前,还有很多工作要做。开发疫苗仍需要做一些基础研究,包括病毒如何调控宿主对感染的反应以及病毒编码蛋白在体外和体内如何逃避宿主防御系统。这些工作能促进减毒活疫苗的开发。还需要更多关于免疫保护机理方面的信息,以及能够诱导免疫保护的病毒抗原,这些将有助于亚单位疫苗的开发。进一步的基础研究是病毒与巨噬细胞相互作用,包括进入、复制和形态学变化,这些将有助于改进病毒复制和疫苗生产的细胞系,并确定疫苗的开发策略。进一步了解ASFV在家猪和野猪中传播的机理将提升控制效果,因为可以采取措施切断这些传播途径。非洲猪瘟病毒全球研究联盟最近发布了一份更完整的研究战略报告。
下一篇: 杨利:育肥猪群生长曲线测定实践
上一篇: 一例猪伪狂犬、大肠杆菌和链球菌混感的诊治
京ICP备13017971号地址:北京市朝阳区农展北路55号
北京华牧直通广告有限公司 版权所有 电话:010-59195279Email:zgzysyw@126,com