前 言
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种在猪之间的烈性传染病。目前,该疾病已被列为必须向世界动物卫生组织(WOAH)报告的严重疾病。自非洲猪瘟爆发以来,给全球养猪业带来了难以弥补的经济损失,我国也不例外。为了防治非洲猪瘟带来的严重经济影响,控制和根除非洲猪瘟至关重要。疫苗接种是预防和控制非洲猪瘟扩散的最佳策略,但由于当前的非洲猪瘟病毒灭活疫苗的保护性差,并且没有足够高效的体外ASFV复制生产的细胞系,给猪瘟疫苗的有效推广蒙上了阴影。因此仍然需要开发具有高免疫保护潜力且易于扩大化生产的非洲猪瘟疫苗。
非 洲 猪 瘟 病 毒
非洲猪瘟病毒具有二十面体对称性,直径为260 nm,呈同心圆结构,分为病毒核心,核心壳层,双层内膜,衣壳,外囊膜等5层。
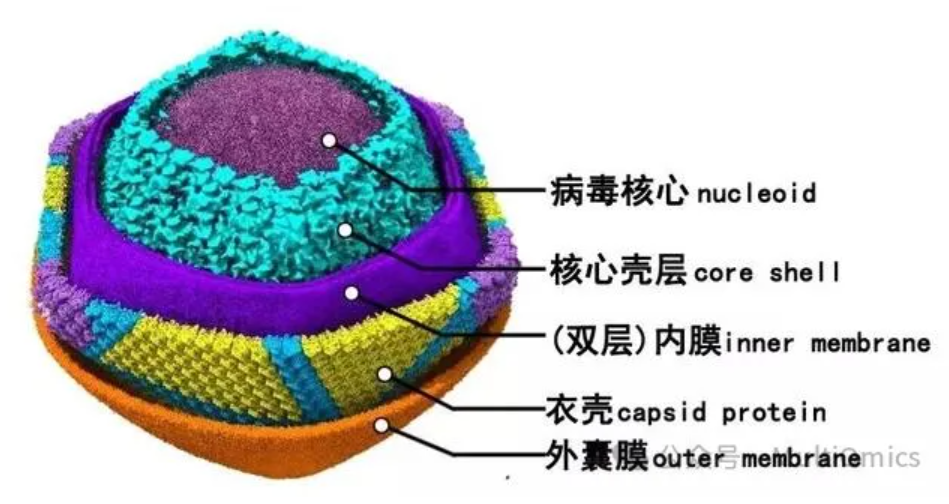
图一:非洲猪瘟病毒颗粒结构图
ASFV基因组长度在170-190kb,包含可变数量的开放阅读框架(ORFs),范围从160到175个,可编码150-200个病毒蛋白,包括68个结构蛋白和100多个非结构蛋白。
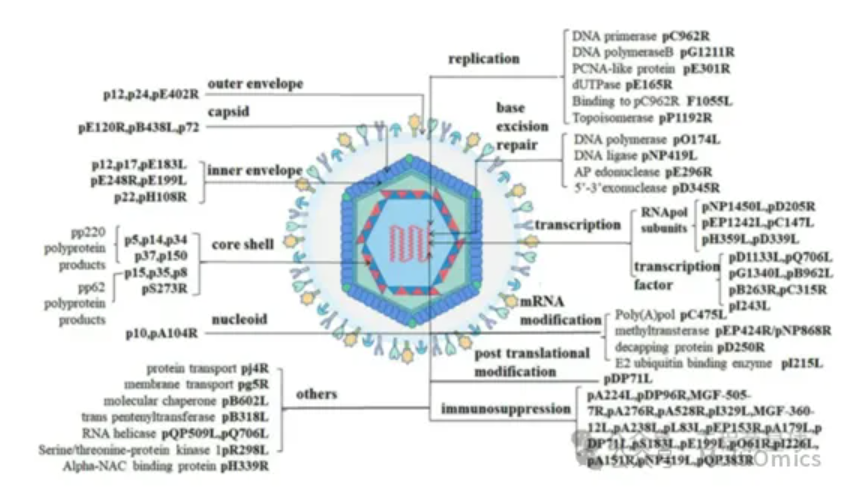
图二:非洲猪瘟病毒颗粒编码基因
ASFV形态发生在高尔基体和微管组织中心附近的核周病毒工厂,病毒组装的第一个迹象是从内质网池中形成病毒膜前体,衣壳逐渐组装后,这种病毒膜前体成为多面体中间体。随着衣壳的形成,病毒核心在病毒的内膜下组装,然后细胞内的成熟病毒工厂被转移到细胞表面,并通过从质膜出芽离开宿主细胞相对于其他病毒来说,非洲猪瘟病毒更为复杂,体型也非常巨大,其生物学机制也相对复杂。
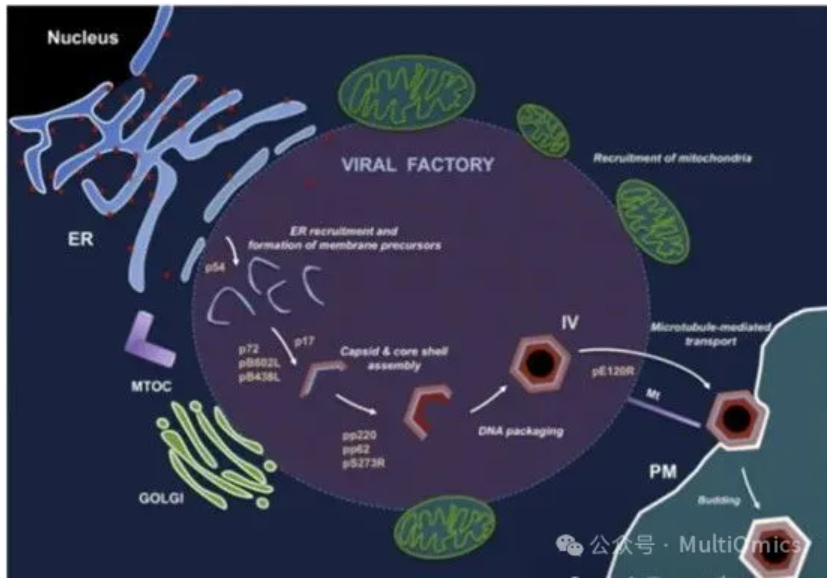
图三:非洲猪瘟病毒颗粒感染过程与原理
2019年,中国科学院生物物理研究所饶子和/王祥喜团队和哈尔滨兽医研究所步志高团队联合上海科技大学、清华大学、中国科学院微生物研究所、中国科学院武汉病毒研究所、南开大学等单位,合作在国际学术期刊 Science 上发表了题为 Architecture of African Swine Fever Virus and implications for viral assembly(非洲猪瘟病毒结构及装配机制) 的学术论文,率先解决了这一世界级难题,为后续的科学研究和药物疫苗提供了足够的理论基础。
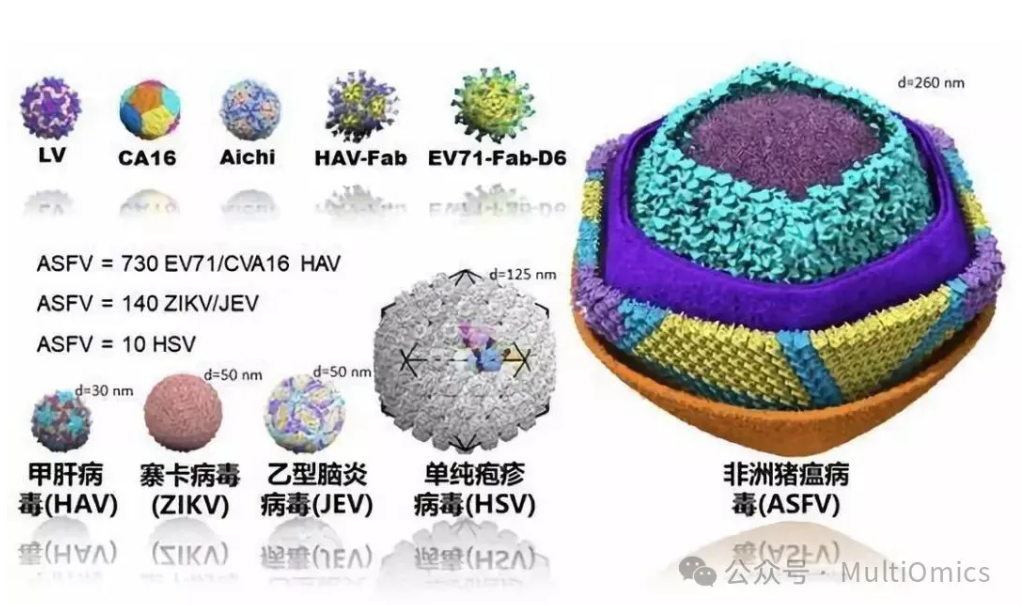
图四:非洲猪瘟病毒与其他病毒颗粒
ASF 疫 苗 开 发
ASF疫苗仅在国内就拥有超过10亿头的市场容量和百亿级别的市场规模。在灭活疫苗、减毒疫苗、亚单位疫苗、载体疫苗以及核酸疫苗上近年来均有不同的进展。
Walczak等人通过分析从ASF存活动物身上收集的血清中和ASFV的可能性,指出抗ASFV抗体本身并不能抑制病毒复制。研究人员指出,这可能是由于ASFV特异性抗体并不能中和病毒:虽然灭活疫苗具有抗原性,但不能引起完全的细胞免疫反应,导致保护并不完全,将灭活的ASFV用作疫苗可能不切实际。Pikalo等人通过给断奶仔猪接种疫苗,42天后再接种高致病力的“Armenia-2008”毒株,证明灭活疫苗免疫对高致病性的“Armenia-2008”ASFV 毒株没有保护,虽然实验表明接种灭活疫苗的动物体内含有特异性IgG,但没有保护作用。上述试验获得了类似的结论,现有的数据证明使用现有方法开发有效的ASFV灭活疫苗存在挑战。
2022年6-8月,越南与美国共同开发的减活疫苗在临床生产使用时出现较多接种后生猪死亡,这个结果给减活疫苗的研发蒙上了阴影。但是,目前哈尔滨兽医研究所在研的ASFV-7GD减活疫苗已在黑龙江、新疆和河南三个养殖基地开展临床试验,备受关注;普莱柯与中国农业科学院兰州兽医研究所合作的亚单位疫苗也已向农业农村部提交兽药应急评价材料;华中农大与企业进行合作研发的基于病毒载体的ASFV疫苗也即将完成转基因生物安全评价。
在mRNA疫苗开发方面,默沙东动物集团推出的Sequivity IAV-S NA打响了兽用疫苗的第一枪。目前,国内外已有企业陆续公布关于ASF相关mRNA疫苗研制的计划或进展:美国Genvax公司与农业部合作开发saRNA疫苗;金宇保灵去年底与上蓝鹊生物签订《ASF mRNA疫苗合作开发等等。
无论是从哪条途径去开发非洲猪瘟相关病毒。深入研究ASFV基因组学和不同基因的功能(包括与免疫反应相关的基因)对于开发ASF疫苗都至关重要:P30、P54、P72、CD2v、EP153R等结构蛋白属于ASFV最重要的一类保护性抗原蛋白,其中P54和P72均与病毒吸附有关;其中P30参与病毒入侵;CD2V参与红细胞与感染细胞和细胞外病毒的结合,并与免疫逃逸相关;EP153R则可与MHC-I抗原呈递调控有关;同时P72蛋白组装需要B602L编码分子伴侣的协助。
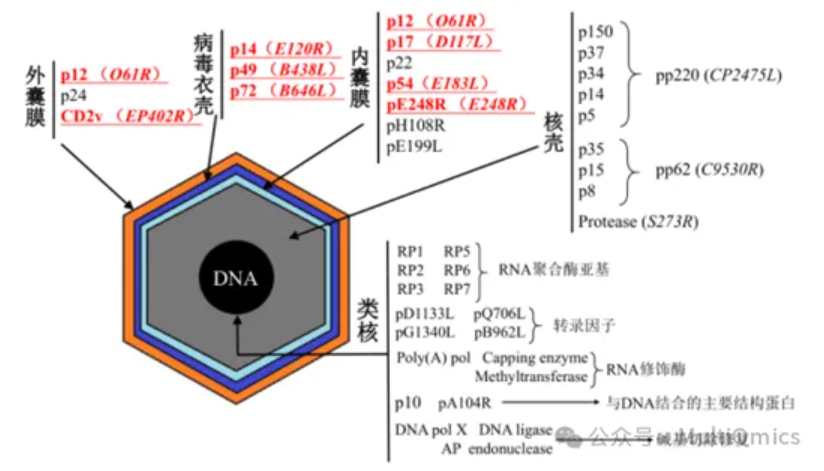
图五:非洲猪瘟病毒颗粒相关重要基因
目前发现可用于制备降低ASFV毒力减活疫苗的相关独立基因并不多,有I177L、9GL、CD2v、A137R、I226R、I267L、NL、UK 和DP148R 等,但是并没有有效可行的商品化疫苗问世。因此发现和表征新的毒力决定基因对于合理开发下一代减毒活疫苗候选株至关重要。
由于易感动物在接触ASFV后会迅速死亡,以往的调查无法确定病毒与宿主之间的联系。大多数实验证实,灭活疫苗会导致疫情进一步扩大,减毒活疫苗会导致免疫猪持续感染、排毒和副作用,而ASFV感染是否会产生中和抗体仍存在争议。此外,不同毒株之间的交叉保护率很低,这使得筛选候选疫苗具有挑战性。根据Qu及其同事的解释,这可能有助于确定疫情中病毒的来源,并有助于ASF疫苗的开发。到目前为止,猪和生物安全三级(BSL-3)实验室限制了疫苗的广泛开发,因此很难获得可靠的动物模型来评估疫苗的免疫效果。大量研究总结了用于确保疫苗接种安全性和评估在实验中使用动物可行性的程序。不幸的是,最近中国农场出现的减毒株导致了慢性疾病、猪群临床副作用和工业威胁。
除了使用多种 ASFV抗原或抗原片段以及优化佐剂和化学制剂的选择外,还应关注现有毒株的保护性抗原及其理想的免疫机制。疫苗始终是预防和控制ASFV的基本策略和最佳工具。未来对ASFV病毒学和功能基因组学的研究将集中在蛋白质结构和功能、感染和免疫机制、作为免疫原的其他保护性抗原的鉴定、增强免疫保护的疫苗目标以及在目标动物中的全面测试等主题上。安全性和免疫效果也应在未来的研究中进行评估。
非洲猪瘟疫苗新方向——细胞免疫
由于大多数灭活疫苗提供的保护非常有限,对于非洲猪瘟的积极控制现在主要还依赖于改良性活病毒疫苗(MLVs)的开发。尽管保护的相关因素尚未完全理解,但改良活疫苗(MLVs)被广泛人为可以很好的用于预防和治疗。不过,它们确实也存在某些限制和风险,包括对异源PRRSV株的保护有限和潜在的回复毒力,特别是灭活疫苗效果不佳也会对异源的保护力弱;同时,中和抗体一般在感染后期才会出现,也给相关的防控效果带了不利因素。
PRRSV一般会在体液和细胞两个方面调节宿主的免疫反应,从而来调控免疫抑制以及继发性感染与扩散,受到感染的动物会表现出延迟的中和抗体反应以及干扰素(IFN)分泌的中断,从而有利于病毒的复制和传播。PRRSV同时还降低了感染细胞中MHC-I的表达,有效抑制新生抗原的呈递以及后续细胞免疫对于病毒感染的扩散。
在猪体内,MHC-I存在三个经典的I型猪白细胞抗原复合体(SLA-I) 基因(SLA I-1/2/3)编码的分子,并能够在所有的有核细胞上表达。这些细胞表面蛋白结合并呈递抗原给CD8+ T细胞,以引起细胞毒性反应。此外,CD8+ T细胞记忆的产生保护宿主免受复发性感染。在未受感染的细胞中,MHC-I呈递内源性肽,主要是胞质肽,以信号显示它们未被感染。大多数CD8+ T细胞表位由免疫蛋白酶体产生,这是一种ATP依赖的蛋白酶复合体,它裂解泛素化的蛋白质。然而,还存在其他抗原加工途径,包括自噬和由furin及信号肽肽酶的蛋白质裂解。经典的蛋白酶体衍生肽由与抗原加工相关的ATP依赖蛋白复合体称为转运体,即TAP1/2,结合并运输到内质网(ER)中。在ER内,肽由肽装载复合体(PLC)装载到未成熟的MHC-I α链上。这个链形成一个肽结合槽,并能够与大多数长度为9个氨基酸(8-12)的肽段结合。由于空间阻碍,更长的肽很少被结合。一旦MHC-I分子装载完成,它就获得了成熟构象,从PLC解离,并被运输到细胞表面,向CD8+ T细胞呈递抗原。这些T淋巴细胞识别呈递抗原的细胞为感染细胞,并启动细胞溶解过程,包括产生和分泌细胞毒性颗粒和细胞因子,如干扰素γ(IFNγ)和肿瘤坏死因子α(TNFα)。
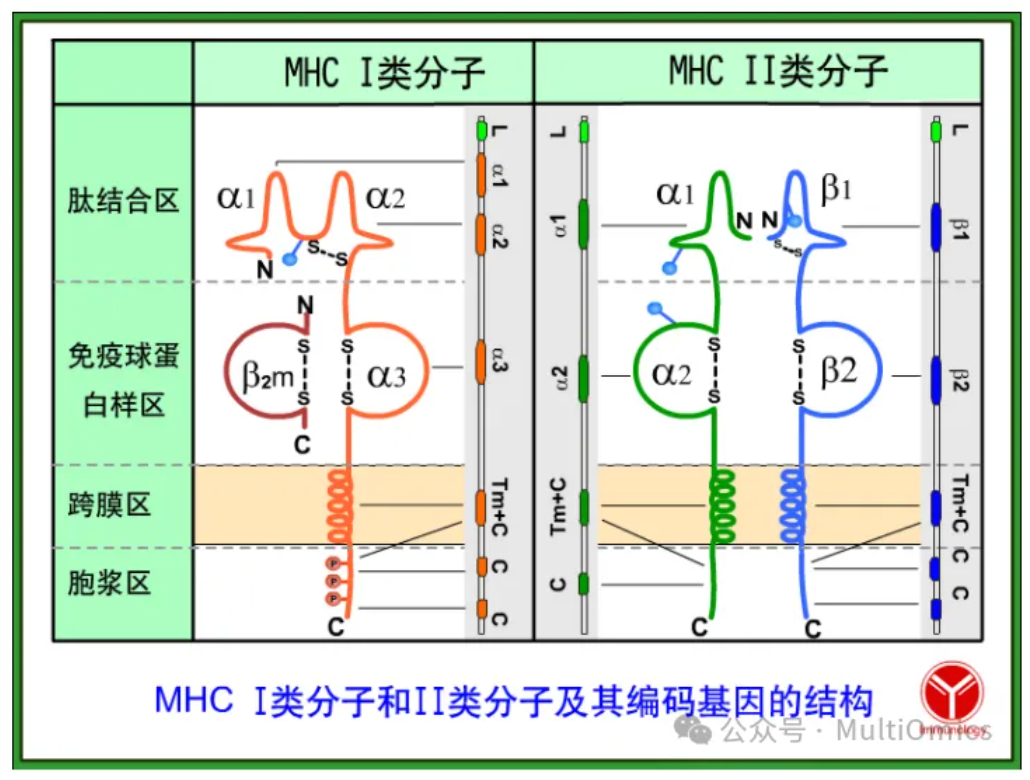
图六:MHC分型
因为抗体反应通常不足以清除病毒,CD8+ T细胞被认为可能是另一个重要的非洲猪瘟病毒保护相关因素。迄今为止,已有几项研究调查了随机生成或预测的PRRSV衍生肽的免疫潜力,然而,目前尚不清楚这些肽是否在体内合成并被真实的提呈到细胞表面并从而引起免疫反应。免疫蛋白酶体通常在疏水性和碱性氨基酸后切割蛋白质,因此,某些预测或随机产生的肽是否在细胞内被合成并呈递,还需要通过实验来确定。
研 究 方 法
细胞免疫研究的核心问题是首先要识别由MHC-I(I类主要组织相容性复合体)结合的病毒肽段,并确认它们具有很好的刺激CD8+ T细胞的能力。
基于这样的出发点,研究人员:
1、从PRRSV(株AUT15-33)感染的细胞(SLA-I Lr-Hp)中免疫沉淀MHC-I/肽复合物,以分离病毒表位,并使用液相色谱与串联质谱(LC-MS/MS)进行分析。
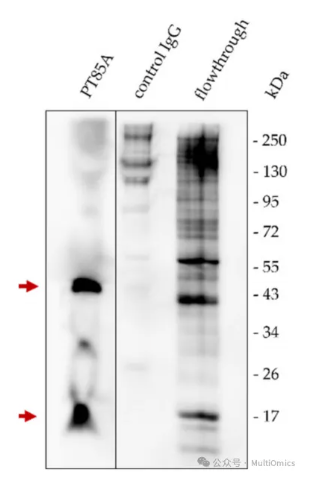
图七:MHC复合物提取富集
利用抗MHC-I抗体PT85A对非洲猪瘟来源样本的裂解液进行MHC-I复合物,进行富集;富集产物使用SDS-PAGE分析富集情况,然后进行Western blot验证。用亲和素-HRP检测生物素标记的细胞表面蛋白,确认成功分离了45 kDa的MHC-I α链和12 kDa的β2微球蛋白分子,并且没有其他细胞蛋白的主要污染(见图七)。对照IgG进行的免疫沉淀也显示出细胞裂解液中没有非特异性结合。
以未被感染的细胞作为对照,利用被PRRSV菌株AUT15-33感染的猪巨噬细胞(PAMs)进行免疫肽组分析,研究人员发现PRRSV感染会导致MHC-I的下调。通过免疫荧光确认了细胞的成功感染情况;收获后,通过免疫沉淀分离了MHC-I/肽复合物。洗脱样品通过LC-MS/MS分析,获得的质谱数据与AUT15-33和Sus scrofa两个蛋白质数据库进行比对分析,结果显示:对未感染的PAMs样本进行数据库研究,这些样本与Sus scrofa蛋白质组匹配,共鉴定出2387个肽组,肽链长度在7到13个氨基酸之间,绝大多数(63.64%)是九肽(图八-a)。
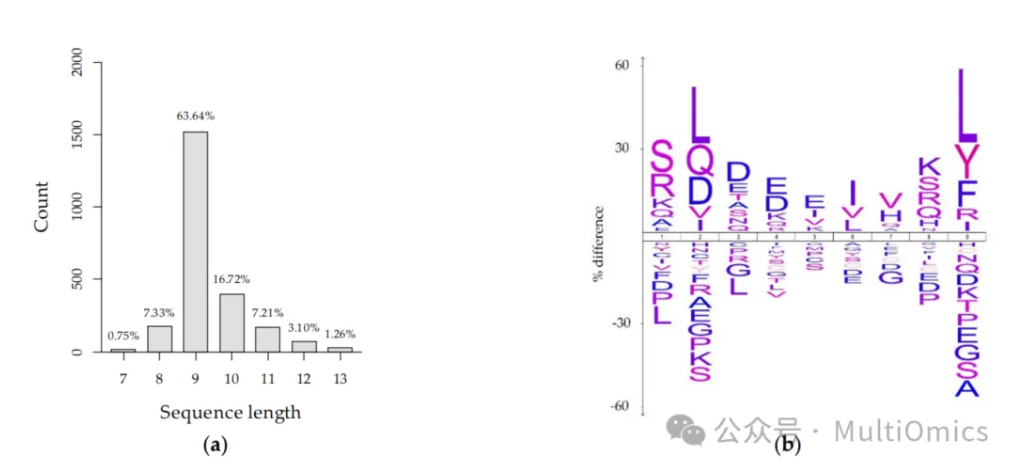
图八:MHC复合物提取富集
这些发现与文献一致,表明大多数MHC-I结合肽的序列长度为九个氨基酸。此外,已知表位锚定残基倾向于是疏水性或碱性氨基酸。数据也证实了在9肽的锚定残基(位置2和9)处疏水性氨基酸的保守性(图八-b)。
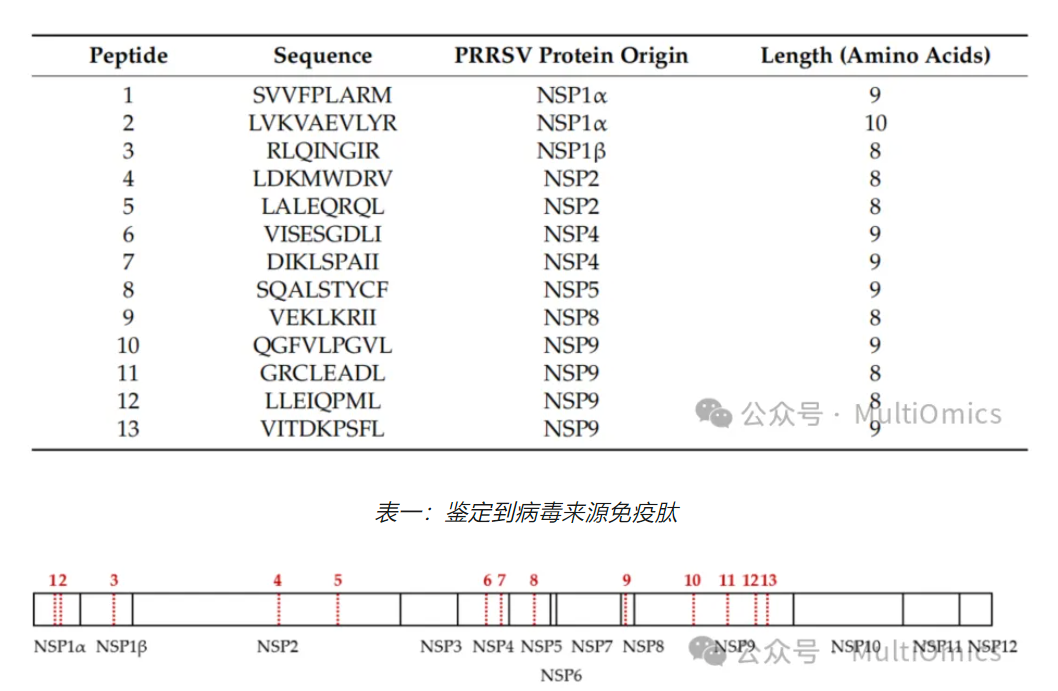
图九:免疫肽相关蛋白质在ORF1中位置
值得注意的是,把采集的免疫肽组质谱数据与AUT15-33蛋白质数据库进行比对分析,研究人员检测到了来源于ORF1的多个编码病毒非结构蛋白(NSPs,表1,图九)来源的免疫肽组结果:其中七个免疫肽段与四种病毒蛋白酶相匹配——NSP1α、NSP1β、NSP2和NSP4,一个肽段来自跨膜蛋白NSP5,另一个来自NSP8,四个肽段与NSP9相匹配,即病毒RNA依赖性RNA聚合酶。为了确认通过LC-MS/MS获得的病毒肽序列的正确性,研究人员进一步对相关免疫肽段的免疫原性进行了验证。
2、利用这些已识别的肽段刺激先前感染过PRRSV猪的外周血单核细胞(PBMCs),并通过细胞内细胞因子染色(ICS)测量PRRSV特异性CD8+ T细胞反应。
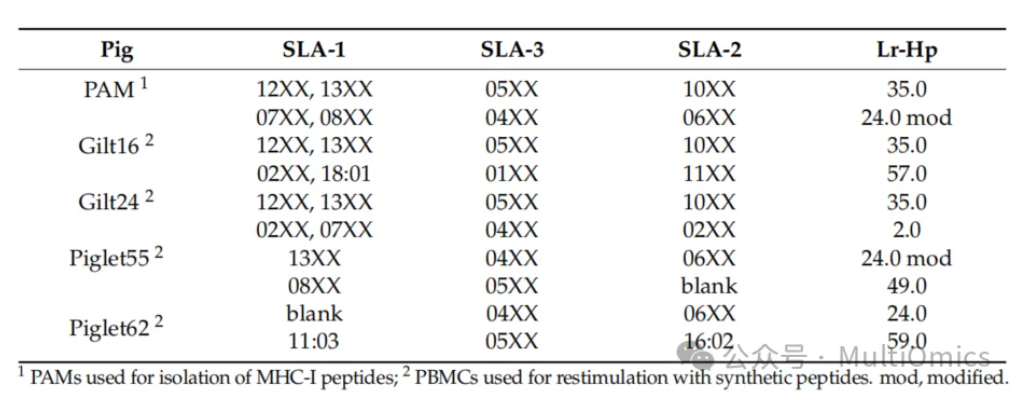
表二:细胞及猪分型信息
研究人员筛选出13个最可靠的的PRRSV ORF1衍生肽段和两个Sus scrofa衍生肽段(C1:ELNDRFANY, C2:KLRDLEDSL)进行肽段的合成,并通过体外PBMCs的再刺激和随后的ICS评估其免疫原性。ICS相对于传统的ELISPOT检测具有更低的背景和更高的灵敏度,并且能够特别筛选CD8+ T细胞的免疫反应情况。研究人员从生物样本库中随机选择了23头仔猪的PBMCs,对合成的15个免疫肽段进行免疫活性分析:结果显示,与阴性对照相比,有两个免疫肽显示出较高的免疫活性。低分辨率单倍型(Lr-Hp)分析结果也显示,本研究中使用的所有PBMCs与PAMs共享相同的等位基因(表2)。
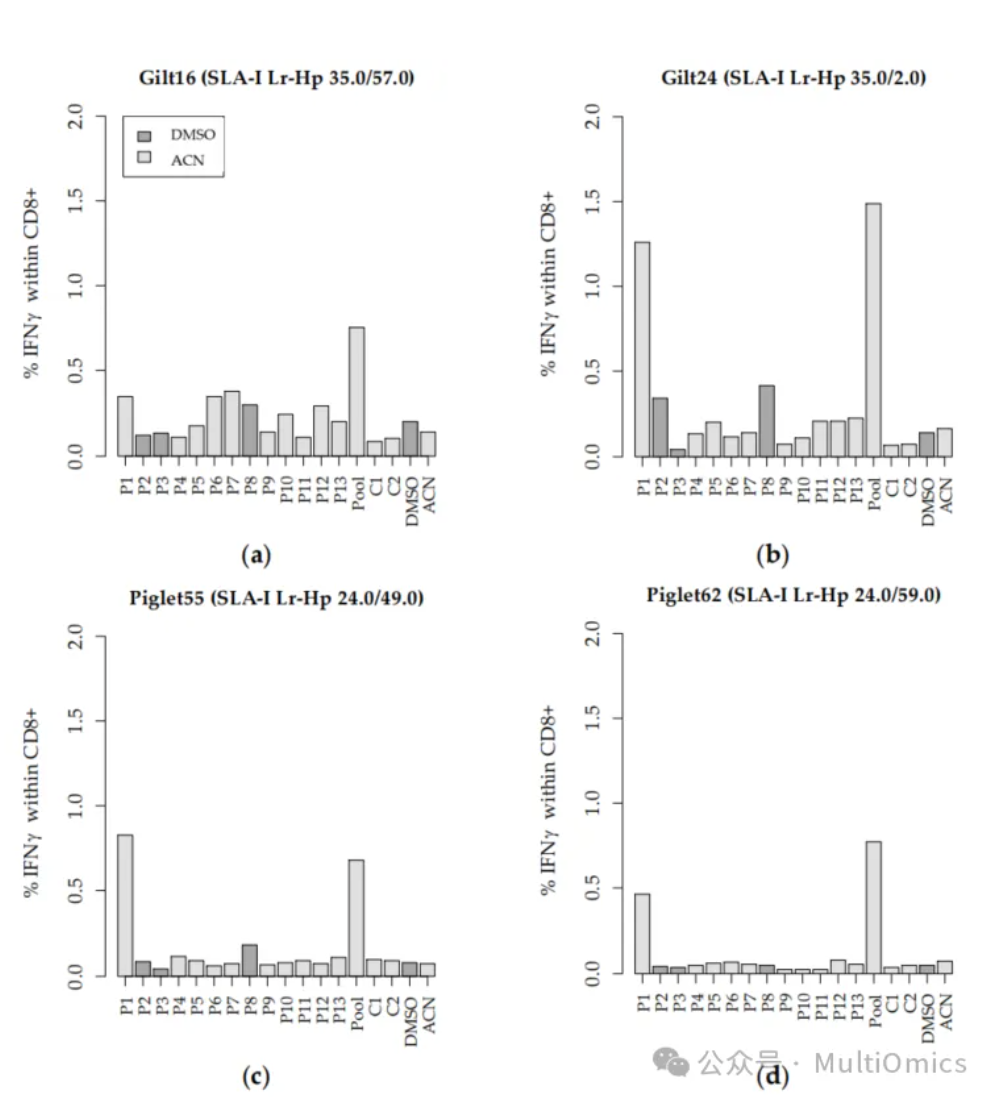
图十:免疫原性ICS实验结果
为了保证结果的可靠性,研究人员又利用四批PBMCs对15个PRRSV肽段(P1-P13)、2个内源性猪肽段(C1和C2)以及混合肽库的免疫潜力进行体外刺激试验的重复评估,同时,增加了阴性对照(ACN/DMSO)以及阳性或激活对照(PMA/ionomycin)。分析结果显示,由所有13种MHC-I结合PRRSV免疫肽肽段等量组成的肽库,在所有批次中均诱导了CD8+ T细胞特异性IFNγ反应,且比阴性对照高出5.4至10.5倍(图十)。在用肽库重新刺激后,总CD8+ T细胞群体中有0.69%至1.49%比例的细胞产生抗原特异性IFNγ,而TNFα或IFNγ/TNFα共激活的CD8+细胞数没有显著增加。值得注意的是,肽1(P1)在所有批次中显示出最强的IFNγ反应,占总CD8+ T细胞群体的0.36%至1.26%。从未感染细胞中分离的MHC-I结合猪细胞来源的免疫肽(C1和C2)并没有诱导IFNγ的产生,证实了它们的内源性特性。
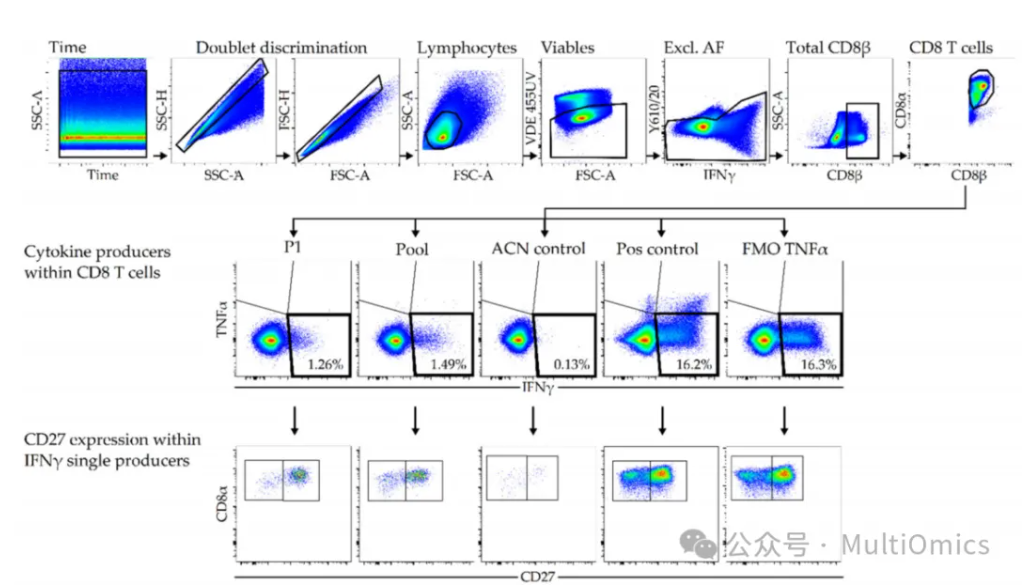
图十一:免疫原性细胞分选结果
此外,我们使用了未激活T细胞的标签-CD27进行染色。在分化为效应(记忆)表型的过程中,CD27表达会耗尽。在该研究中,用肽库和单一肽段刺激显示与阳性对照PMA/ionomycin相比,未激活或CD27+CD8+T细胞的频率更高,PMA/ionomycin是一种强有力的刺激(图十一)。在PMA/ionomycin刺激的细胞中,有31.7%至70.1%,在肽库刺激的细胞中有43.4%至73.0%,在P1刺激的细胞中有60.7%至88.9%属于这种未激活群体。与肽库和阳性对照刺激相比,用P1重新刺激的PBMCs中CD27−CD8+细胞的数量最低,这代表了一个高度分化的T细胞表型。
结果显示,混合免疫肽库比单一肽段表现出更好的T细胞诱导能力。
结 论








