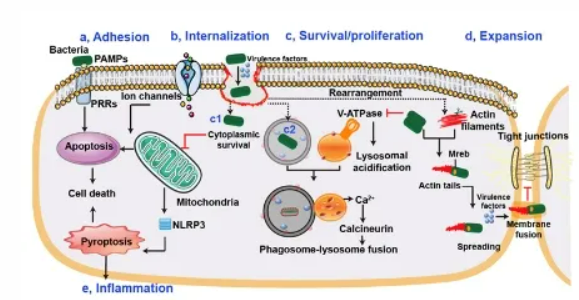
2月7日,微生物和化学生物学顶级期刊 Trends in Microbiology在线发表了中国农业大学动物医学院沈建忠团队题为“Host acting antibacterial compounds combat cytosolic bacteria”的综述文章(IF=17.079),系统介绍了宿主导向的抗菌化合物在对抗胞质细菌上的最新研究进展和潜在应用价值。
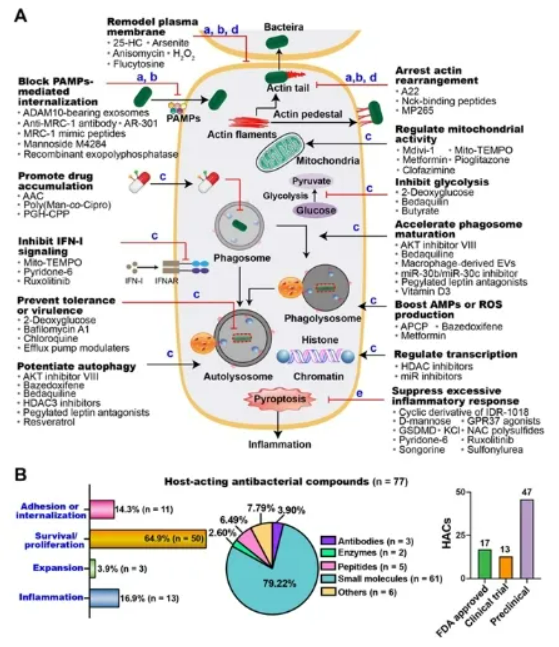
多重耐药菌引起的感染已经成为全球公共卫生安全最严重的威胁之一,然而天然药物分子库的枯竭,以及尚未阐明的细菌耐药机制都极大地阻碍了新型抗菌药物的研发及应用。沈院士团队长期致力于耐药细菌防控,并且已经在新型抗菌药物研发,细菌耐受性机制以及宿主及共生菌相互作用方面开展了一系列基础性和应用性研究。近年来,由宿主细胞介导的致病菌耐药性或耐受性获得了越来越多的关注。许多致病菌可以适应细胞内环境,以短暂且不生长的生活方式在其中存活,而这些胞内菌也被统称为胞质细菌(Cytosolic bacteria)。胞质细菌不仅可以利用宿主细胞作为天然屏障来抵御抗菌药物杀伤,同时它们还会破坏宿主代谢及免疫功能来避免被清除。为了对抗细菌抗菌药物耐药性及耐受性,前期研究揭示了低浓度抗菌药物和细菌毒素可以促进胞质细菌抗菌药物耐受性的产生(Adv Sci, 2020, 7, 1900840),成功合成了广谱抗菌增效剂SLAP-S25(Nat Microbiol, 2020, 5, 1040)以提高抗菌药物在细胞水平及动物体内的疗效。同时,鉴于病原微生物与宿主细胞间复杂的相互作用,进一步关注胞质细菌感染下的宿主细胞防御策略,发现植物源黄酮类化合物(Adv Sci, 2021, 8, 2100749)特别是新型聚集诱导发光分子TBPs可以通过调控自噬来加速感染清除(Adv Sci, 2021, 8, 2001750),丰富了近年来提出的宿主导向治疗(Host-directed therapies)作为新型替代抗策略。结合上述研究基础并为给后续新型药物研发提供抗菌靶点,本文综述了近五年内宿主导向抗胞质细菌的化合物(host acting antibacterial compounds, HACs)及其作用机制。不同于传统抗菌药物,HACs侧重于细菌与细胞互作层面,通过阻断病原菌对宿主细胞生理活动的胁迫,恢复或增强宿主细胞的代谢及抗菌功能来抑制病原菌感染。新型抗菌药物研发离不开抗菌新靶点的发现。细菌通常以独特的时空动态入侵细胞(图1),HACs潜在的抗菌靶点贯穿了整个感染过程,并可分为阻断细菌粘附和入侵、抑制胞质细菌的生存和复制、防止病原菌扩散和抑制过度的炎症。此外,即使作用于同一阶段的HACs也可以通过完全不同的信号通路来调节宿主细胞与病原菌的相互作用。作者将HACs以不同功能进行分类,包括重塑宿主细胞质膜、阻断PAMPs(pathogen-associated molecular patterns)介导的细菌内化、促进细胞内药物累积、抑制宿主IFN-I信号、抑制胞质细菌耐受性及毒性、提升宿主细胞自噬功能、恢复线粒体功能、抑制糖酵解、加速溶酶体成熟、促进抗菌肽表达和ROS累积、修饰转录、抑制细菌诱导宿主细胞肌动蛋白重排和过度炎症等13种作用方式(图2A)。全文共收录了77种HACs(图2B),其中的50种(64.94%)作用于胞质细菌细胞内生存及复制阶段,作者提出后续研究应积极探索可以阻断细菌粘附和入侵的化合物将感染控制于初始阶段。在所有收录的HACs中,61种(79.22%)为小分子化合物,47种(61.04%)还处于临床前研究阶段 ,提示尽管HACs还处于发展初期,但是可开发资源非常丰富,临床应用前景良好。图2 宿主导向的抗菌化合物(HACs)对抗胞质细菌的作用模式(A)HACs靶向细菌的不同阶段。针对细菌粘附内化,存活/复制,逃逸和炎症各阶段的HACs的作用,将HACs分为13个的类别。(B)现有HACs(77种)靶向细菌粘附或内化,存活/复制、逃逸和炎症阶段的药物数量。现有HACs的类别包含抗体,酶,肽,小分子和其他HACs。最后,作者进一步指出HACs并非直接作用于病原菌,相对较小的选择压力使得细菌更不易产生耐药性,在未来的耐药菌防控中将扮演重要角色。同时,作者辩证认识到HACs可能存在的一些潜在的劣势,包括体内活性的不确定性、细胞毒性及脱靶效应等,将在后续的研究中得到重视。中国农业大学博士毕业生刘晓晔(现为北京农学院专任教师)和吴逸璠(现为深圳大学博士后)为该论文的第一作者,我校引进的杰出人才、沈建忠院士团队的朱奎教授为通讯作者。本研究受广东省基础与应用基础研究重大专项(2020B0301030007),国家自然科学基金(31922083)和高校科学基金(2021RC005和2021TC058)项目资助。